anexo 2
Anexo 2
MECANISMO E ESPECIFICIDADE DE SERINA-PROTEINASES
Para discutir as relações entre estrutura, mecanismo de catálise e especificidade de enzimas, tomaremos como modelo as proteinases que têm uma Ser muito reativa no sítio ativo (por isso chamadas de serina-proteinases) e um mecanismo catalítico comum. Estas enzimas têm a função de degradar outras proteínas, daí o nome proteinase. Entre elas, as melhor caracterizadas são a quimotripsina, a tripsina e a elastase. A última tem esse nome porque é capaz de digerir a proteína de tecido conjuntivo chamada elastina, que praticamente não é clivada por outras proteinases, porque possui grande quantidade de Gly, Ala e Val. As três enzimas são proteinases digestivas produzidas pelo pâncreas e secretadas para o duodeno.
Bolso de especificidade: As três enzimas clivam ligações internas de cadeias polipeptídicas do substrato e essa clivagem é feita na amida que forma a ligação peptídica. A ligação é muito estável e, na ausência de um catalisador, sua meia vida de hidrólise em pH neutro é de 10 a 1000 anos. A especificidade das proteinases difere pelo tipo de resíduo de aminoácido que contribuiu com a carboxila na formação da ligação peptídica. Os resíduos devem ser volumosos e hidrofóbicos para que a quimotripsina tenha atividade; carregados positivamente para sofrer ação da tripsina e pequenos e neutros para que a ligação seja clivada pela elastase. Essas preferências são um reflexo dos aminoácidos que compõem o bolso de especificidade, localizado próximo aos resíduos catalíticos. Na quimotripsina, no fundo de um desses bolsos, há um resíduo de Ser, que é substituído por um resíduo de Asp na tripsina. Já na elastase, as paredes laterais possuem aminoácidos volumosos no lugar das Gly presentes nas outras duas enzimas, permitindo somente a entrada de aminoácidos com cadeias laterais pequenas (Fig 1).
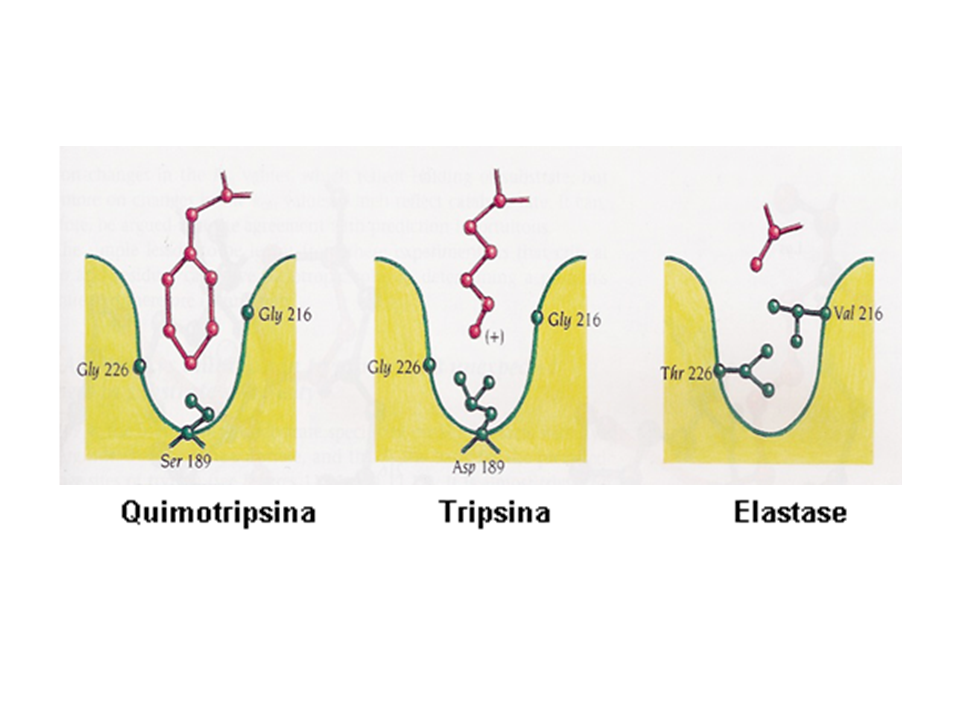
Fig. 1. Sítios que conferem especificidade a diferentes serina-proteinases. Reproduzido de Branden, C., Tooze, J. (1999) Introduction to Protein Structure. 2nd ed. Garland, New York.
Mecanismo de ação da quimotripsina
Um esquema do mecanismo de ação da quimotripsina está apresentado na Figura 2, que deve ser analisada enquanto se lê o texto abaixo. Este mecanismo também poderá ser analisado num software (Voet).
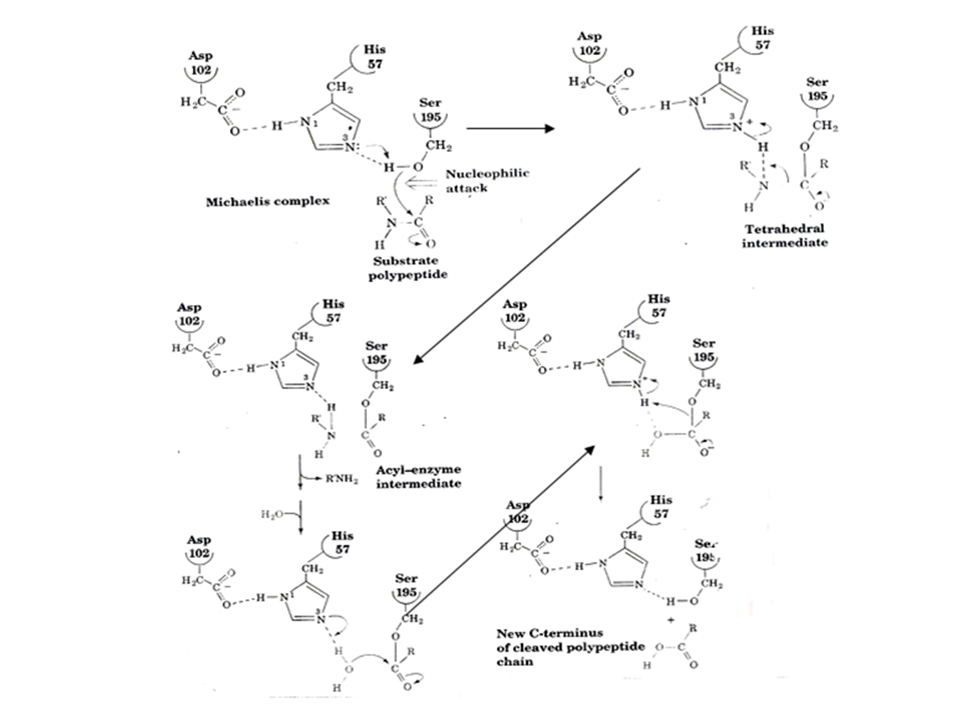
Fig. 2. Mecanismo catalítico da quimotripsina. Detalhes no texto.
Quando o substrato se liga ao sítio ativo, a serina da posição 195 (Ser195), que é o principal grupo catalítico, faz um ataque nucleofílico na carbonila da ligação peptídica a ser clivada. Isso é facilitado pelo fato do imidazol da His ligar o H+ que é liberado. Essa tomada do H+ pela His é, por sua vez, auxiliada pela presença do resíduo de Asp que faz uma ligação de hidrogênio com a His. Esses três resíduos são chamados de tríade catalítica, pois, embora só a Ser seja essencial para a catálise, a constante catalítica decresce algumas ordens de grandeza se não houver a His ou Asp nessas posições.
Após o ataque nucleofílico e a transferência do H+, o C da carbonila da ligação a ser clivada torna-se tetraédrico e há uma distorção na molécula de substrato, que faz com que o oxigênio dessa carbonila ocupe uma região mais no interior do sítio ativo, ocupando a região conhecida como “cavidade do oxiânion”. Nessa região, ele forma duas pontes de H com a enzima que não podem ser formadas quando o grupo está na sua forma normal (estado fundamental do substrato). Além disso, forma-se mais uma ligação de H entre o grupo NH da ligação que será clivada. Desse modo é formado um intermediário tetraédrico, que é o estado de transição da reação. A enzima liga melhor o intermediário tetraédrico do que o substrato. Esse intermediário se decompõe formando uma acil-enzima (cadeia do substrato ligada a Ser covalentemente pela carboxila). A nova porção N-terminal da proteína, que estava interagindo com o imidazol da His é liberada para a solução e substituída por uma molécula de água.
Os passos anteriores praticamente se repetem agora. A água é desprotonada pelo imidazol, adiciona-se ao carbono carbonílico gerando o mesmo intermediário tetraédrico. Esse se decompõe formando o outro fragmento peptídico e a Ser é re-protonada.
A Ser presente na quimotripsina é extremamente reativa e, para isso, a cadeia lateral precisa perder um H+. Em solução, a cadeia lateral da Ser não desprotona. Desse modo, o arranjo próximo da Ser com His e Asp, que só é conseguido dentro do sítio ativo da enzima, permite essa reatividade.
O fato do sítio ativo apresentar uma conformação tal que liga melhor o estado de transição que o estado fundamental do substrato é muito importante para a catálise. A quimotripsina nativa aumenta a velocidade da reação por um fator de cerca de 1010. Quando os três resíduos da tríade catalítica são mutados, a enzima ainda aumenta a velocidade da reação não catalisada em cerca de 104 vezes, aumento que é atribuído à maior ligação do estado de transição.
Estrutura da quimotripsina
A cadeia da quimotripsina é formada por dois domínios do tipo b-barril, cuja topologia é um motivo chave grega (fitas 1-4), seguido por um motivo grampo (fitas 5 e 6) (Fig. 3). O sítio ativo está situado em uma fenda entre os dois domínios. O domínio 1 contribui com dois resíduos da tríade catalítica, His 57 e Asp 102, enquanto que a Ser 195 é parte do segundo domínio (Fig. 4). Apesar dessa descrição simples, a estrutura real parece um pouco complicada, porque um barril está torcido em relação ao outro e eles estão um pouco distorcidos (Fig. 3).
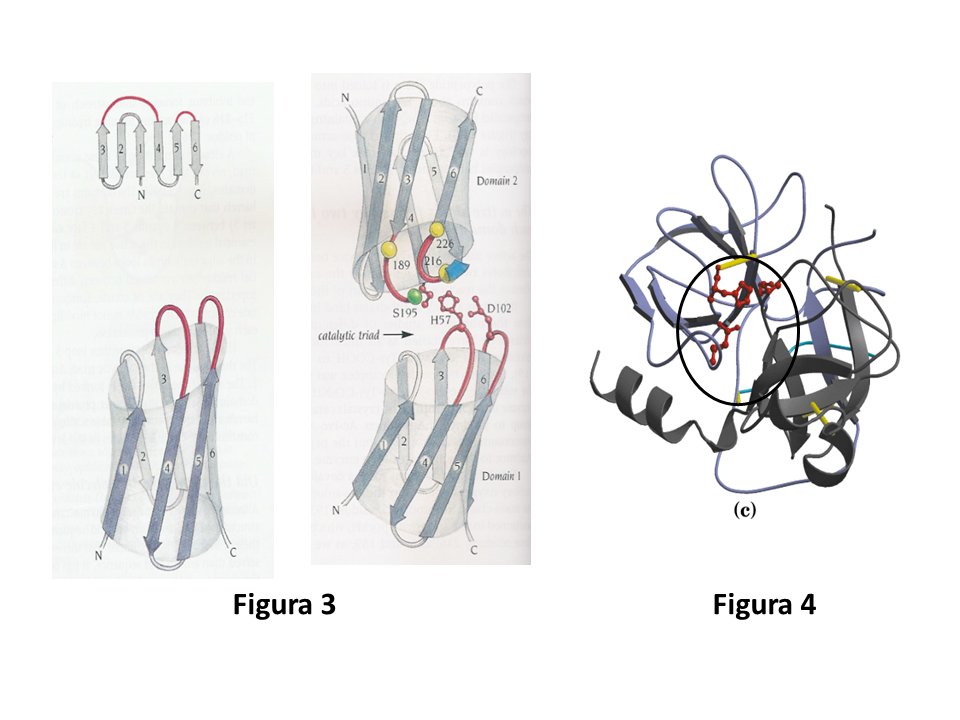
Figura 3. A figura da esquerda mostra o arcabouço de um dos domínios da quimotripsina como constituído de chave grega e grampo. A figura da direita mostra a disposição da tríade catalítica em relação aos dois domínios da quimotripsina. Reproduzido de Branden, C., Tooze, J. (1999) Introduction to Protein Structure. 2nd ed. Garland, New York.
Figura 4. Estrutura 3D da quimotripsina. No círculo, a tríade catalítica