Roteiro da Semana 10
Perspectivas terapêuticas das células-tronco
O conceito básico de células-tronco
Nosso organismo pode ser visto como um conjunto de órgãos - coração, pulmões, fígado etc. - que, interagindo entre si e com o meio ambiente, garante o bom funcionamento do todo. Cada um desses órgãos, por outro lado, é formado a partir da interação de vários tipos de células, que constituem assim a unidade funcional do organismo.
São reconhecidos mais de 200 tipos de células no corpo humano colaborando entre si para formar os tecidos. As células têm uma vida dinâmica no organismo, surgindo pela divisão de uma célula precursora, desenvolvendo-se e morrendo. Uma célula pode assim, em dado momento, seguir um entre três diferentes “destinos”, que dependem da resposta que ela dá a estímulos que chegam do microambiente onde vive. Em primeiro lugar, a célula pode proliferar, isto é, dividir-se pelo processo de mitose, originando outras duas células. Ela pode também mudar de tamanho e forma, passando a realizar alguma função mais especializada, processo denominado diferenciação.
Finalmente, a célula pode morrer, num processo que é planejado pelo organismo e é chamado “morte celular programada”. A morte celular é um processo muito importante para a manutenção adequada do organismo e, praticamente, todas as células em espécies de vida mais longa, como o homem, são programadas para uma substituição periódica. Para a grande maioria das células, a morte acontece por um mecanismo fisiológico denominado apoptose, por um prazo que pode variar entre alguns dias e alguns meses após sua formação. Este processo é muito acentuado para alguns tipos de células como as sanguíneas (que são repostas aos milhões a cada hora) ou, como se torna mais visível para nós no verão, para as células que formam a pele. Outras células, como as que compõem o sistema nervoso, são consideradas permanentes, embora, mais recentemente, tenha sido observada a existência de renovação celular mesmo para elas.
Vemos assim que, mesmo depois de concluído o período de crescimento, quando o número de células necessariamente aumenta, o organismo deve continuar a produzir novas células. Para a maioria das células do organismo, a renovação ocorre a partir de células-tronco (CTs) que existem nos diferentes tecidos.
Chegamos assim ao conceito básico de célula-tronco, apesar de esse conceito - ao menos para as CTs presentes no organismo adulto - ainda não estar completamente definido. Geralmente, é aceito que elas são as únicas a apresentarem simultaneamente duas propriedades.
- Em primeiro lugar, elas são capazes de proliferar originando, por mitose, duas células filhas exatamente iguais entre si e iguais à célula original. Para todas as outras células do organismo, a proliferação é acompanhada de diferenciação, de modo que a mitose origina duas células já um pouco mais maduras que a original.
- Em segundo lugar, as CTs são capazes de, quando submetidas aos estímulos adequados, originar um ou mais tipos de células maduras.
Todos esses conceitos são muito recentes. As células-tronco, em si, foram inicialmente descritas em camundongos na década de 1970. Estudos em roedores progrediram, revelando a grande diversidade e plasticidade dessas células pluripotentes até que, em 1998, elas foram isoladas pela primeira vez no homem, pelos pesquisadores James Thomson (Universidade de Wisconsin) e John Gearhart (Universidade Johns Hopkins), nos EUA, e, a partir desses estudos, os conhecimentos a respeito do assunto têm crescido em velocidade extraordinária.
Modificado do texto de Nance Beyer Nardi
Animação 3 - Fontes de células-tronco adultas
Para continuar a descrever as características das células-tronco e suas aplicações, é importante que se faça uma distinção. Até agora foram apresentadas as células presentes no organismo adulto, responsáveis pela manutenção dos tecidos. Existe, entretanto, uma outra categoria de CTs, que são aquelas presentes no embrião. As duas categorias de células-tronco - embrionárias e do adulto - exibem diferenças em características biológicas, na metodologia de obtenção e manutenção, no potencial de aplicação terapêutica, e nas implicações éticas e legais de sua manipulação
Animação 4 - Diferenciação celular
Células-tronco: progressos científicos
Os cientistas apostam muito nas células-tronco. Espera-se que inúmeras doenças, entre elas as neuromusculares, o diabetes, o mal de Parkinson e as lesões de medula possam ser tratadas pela substituição ou correção de células ou tecidos defeituosos. A terapia celular com células-tronco representa também um grande avanço nas técnicas hoje existentes de transplante de órgãos. Se as pesquisas derem os resultados esperados, deverá ser possível, no futuro, fabricar tecidos e órgãos em quantidade suficiente para todos. Seria o fim das longas filas de transplante de órgãos. Do mesmo modo que trocamos peças do nosso carro poderemos substituir ou corrigir a função de órgãos com defeitos.
Há vários entraves de ordem técnica, que precisam ser vencidos para que as células-tronco possam passar a ser empregadas rotineiramente em terapia celular.
Vídeo introdutório
Um dos principais objetivos das pesquisas com células-tronco embrionárias humanas é identificar como as células indiferenciadas se tornam diferenciadas. Os cientistas sabem que ligar ou desligar determinados genes é um processo crucial. Algumas das mais sérias condições médicas, como câncer e defeitos congênitos, são causadas por anormalidades na divisão celular anormal e na diferenciação. Uma melhor compreensão do controle genético e molecular desses processos pode dar informações sobre como tais doenças ocorrem e sugerir novas estratégias para terapia. Os cientistas ainda não compreendem completamente os sinais que ligam ou desligam genes na diferenciação das células-tronco.
Uma aplicação potencial das células-tronco é a geração de órgãos e tecidos para substituir tecidos lesados e que atualmente só é possível a partir de doação de órgãos de pessoas com morte cerebral. Para realizar as promessas de uso, os cientistas devem ser capazes de reproduzir, manipular e diferenciar as células em número suficiente para os transplantes. A seguinte lista de passos precisa ser obtida:
- proliferar extensivamente e gerar quantidades suficientes de tecido,
- diferenciar as células no tipo celular desejado,
- garantir a sobrevivência das células no corpo do transplantado após o transplante,
- garantir a integração das células transplantadas no tecido do receptor,
- garantir o correto funcionamento das células durante o período de vida do transplantado,
- evitar qualquer tipo de dano no transplantado, inclusive a rejeição.
Antes que um novo procedimento de terapia comece a ser utilizado no tratamento de doentes, são necessários os seguintes requisitos:
- uma ideia que possa ser testada com base em experimentos científicos – no caso da terapia celular, a ideia é usar células-tronco para reparar ou substituir tecidos ou órgãos danificados.
- pesquisas e testes em laboratório – geralmente, os experimentos preliminares são feitos em placas de cultura com células humanas e de outros animais. Essa etapa inclui o desenvolvimento de diferentes linhagens de células-tronco em laboratório, a verificação da eficácia que cada tipo celular apresenta no reparo de diversos tecidos, etc.
- estabelecimento de um modelo experimental que simule o modo de utilização em seres humanos - modelos de terapia mais refinados são testados em modelos animais. Os resultados devem ser reprodutíveis e a segurança de sua aplicação deve ser provada.
As células-tronco podem ser classificadas de acordo com a sua capacidade de originar outros tipos celulares:
Células-tronco totipotentes: Têm o potencial de formar todos os tecidos bem como um novo indivíduo se inseridas em útero
Células-tronco pluripotentes: Estão na parte interna do blastocisto. Têm o potencial de formar todos os tecidos do corpo humano, mas não mais um novo indivíduo, se inseridas em útero.
Células-tronco multipotentes: Têm o potencial de formar vários tecidos; por exemplo, as células-tronco mesenquimais.
Células-tronco oligopotentes: Têm o potencial de formar poucos tecidos; por exemplo, as células-tronco hematopoéticas.
Células-tronco unipotentes: Têm o potencial de formar um único tecido.
![]() Texto baseado no texto de Zatz M, e Passos-Buento MR, encontrado no site do Centro de Estudos do Genoma Humano.
Texto baseado no texto de Zatz M, e Passos-Buento MR, encontrado no site do Centro de Estudos do Genoma Humano.
Animação 5 - Tipos células-tronco
Comparação entre células-tronco embrionárias e de adulto
a. Características comuns a células-tronco embrionárias e de adulto
• Possuem capacidade de autorrenovação e de dar origem a células especializadas.
• Os cientistas usam técnicas similares para marcar e monitorar a expressão de certos genes a fim de identificá-las.
• São capazes de proliferar e de se especializar quando transplantadas para animais cujo sistema imunológico foi suprimido.
b. Diferenças entre células-tronco embrionárias e de adulto
• A principal diferença está na origem: os cientistas acreditam que as embrionárias existam apenas nos embriões e que as adultas estão presentes em diversos tipos de tecidos do corpo humano.
• As embrionárias são pluripotentes, ou seja, podem dar origem a tecidos provenientes dos três folhetos germinativos (ectoderma, mesoderma e endoderme. Ainda não se sabe se as adultas possuem a mesma capacidade.
• Em laboratório, as embrionárias podem se multiplicar por muitas gerações sem que haja diferenciação; já as adultas sofrem diferenciação.
• As embrionárias, quando injetadas em cobaia cujo sistema imunológico foi suprimido, geram teratomas (mistura de diferentes tipos celulares). O mesmo resultado não é observado com as adultas.
c. Algumas perguntas que ainda precisam ser respondidas a respeito de células-tronco
• Existe uma célula-tronco universal? Ou seja, existe uma célula-tronco que possa gerar células de quaisquer órgãos ou tecidos?
• Quais são as origens das células-tronco no adulto? Elas são “sobras” de células-tronco embrionárias ou elas surgem de alguma outra forma? E se a última alternativa for a verdadeira - como parece ser - exatamente como elas surgem e como elas permanecem em um estado indiferenciado enquanto todas as células ao seu redor se encontram diferenciadas?
• Quantos tipos de células-tronco adultas existem e em quais tecidos
• As células-tronco adultas podem proliferar em meio de cultura até que seja obtida a quantidade necessária para transplante?
• Quais as evidências de que células especializadas geradas a partir de transplantes de células-tronco possam substituir células de tecidos lesados ou danificados
• Quais são os fatores responsáveis pela migração das células-tronco até os tecidos danificados?
Células-tronco: progressos científicos e o futuro das pesquisas
• Quais são os controles intrínsecos que fazem uma célula-tronco se diferenciar em determinado tipo celular em vez de outro?
• Quais os mecanismos que permitem às células-tronco embrionárias proliferar in vitro sem que haja diferenciação?
• Qual o estágio de diferenciação da célula-tronco e o melhor para o transplante? O mesmo estágio é o melhor para qualquer tipo de transplante ou varia de caso para caso?
• Qual o melhor estágio de diferenciação de uma célula-tronco para testar drogas e toxinas
d. Perguntas-chave sobre células-tronco do adulto e células-tronco embrionárias
Há várias questões importantes sobre as células-tronco que permanecem sem resposta. Algumas delas estão listadas abaixo:
• Quantos tipos de células-tronco do adulto existem e em quais tecidos elas existem?
• Quais são as fontes de células-tronco do adulto no corpo? Serão elas células-tronco “remanescentes” das células-tronco embrionárias, ou elas são originadas de outro modo. Por que elas permanecem num estado indiferenciado quando as células ao seu redor foram diferenciadas?
• As células-tronco do adulto exibem plasticidade normalmente, ou elas se transdiferenciam apenas quando manipuladas pelos cientistas? Quais são os sinais que regulam a proliferação e a diferenciação das células-tronco que exibem plasticidade?
• É possível manipular células-tronco do adulto para aumentar sua proliferação de modo que produza células suficientes para um transplante?
• Existe um tipo de célula-tronco de adulto que tenha a capacidade de gerar as células de todos os tecidos e órgãos?
• Quais os fatores que estimulam as células-tronco a migrar para locais lesionados ou danificados?
Emprego de células-tronco
Atualmente, as pesquisas sobre o emprego de células-tronco em terapias ou tratamento de doenças humanas encontram-se em três estágios de desenvolvimento e o uso de modelos animais é fundamental para ajudar a testar estas terapias.
I. Terapia com células-tronco do adulto
Animação 6 - Desenvolvimento de terapias com células-tronco
a) já estabelecidas em humanos para doenças que afetam o sangue
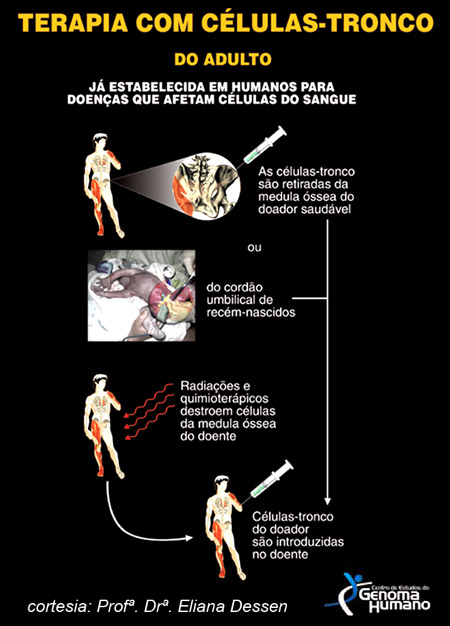
Figura 1
Atualmente, o transplante de medula é a terapia celular mais bem conhecida, e vem sendo empregada com sucesso em casos de terapia de doenças graves que afetam o sangue, como anemia aplásica grave (doença em que não há formação das células sanguíneas), algumas doenças hereditárias (talassemias) e vários tipos de leucemias (leucemia mieloide aguda, leucemia mieloide crônica, leucemia linfoide aguda). O diagnóstico da doença exige, entre outros exames, a avaliação histológica, citogenética e molecular de células da medula óssea do paciente, que são aspiradas geralmente do osso ilíaco ou do esterno (ou da tíbia, em crianças). Antes do transplante, os pacientes devem ser tratados com altas doses de quimioterápicos e radiação para eliminar as células da medula óssea doente. Esse procedimento é delicado, pois faz com que o número de células sanguíneas seja drasticamente reduzido. O tecido sadio de um doador é então introduzido através de uma veia do receptor e as células migram para a medula óssea. Se o transplante tiver sucesso, em um mês a função da medula será restabelecida. Mesmo assim, o paciente deve receber acompanhamento médico durante um período mínimo de um ano após o transplante, para detecção e tratamento de possíveis complicações.
No caso de transplantes de células-tronco autogênicas não há barreiras imunológicas, uma vez que as próprias células do indivíduo são reintroduzidas. Para viabilizar esse procedimento, é necessário que o indivíduo, apesar de doente, tenha um número suficiente de células-tronco sadias. Essa forma de transplante é utilizada, principalmente, em alguns casos de câncer.
São duas as principais preocupações nos transplantes autogênicos: a obtenção de um número suficiente de células sadias e a eliminação completa das células cancerosas presentes no organismo do doente. Várias técnicas estão sendo desenvolvidas para essa finalidade, inclusive o uso de drogas especificamente testadas para agir sobre células cancerosas sem efeito sobre as células sadias. Os transplantes autogênicos geralmente são bem sucedidos, sendo o principal risco a recorrência.
No transplante alogênico (o doador de células é outra pessoa), o principal risco para o paciente é a ocorrência de rejeição ao tecido transplantado. Quando células são retiradas de um doador e transplantadas em um receptor não gêmeo, vários desses antígenos HLA são diferentes. O sistema imunológico do receptor considera essas células como estranhas e tenta matá-las, e as células do doador também tentam eliminar as células do receptor. É aí que se dá o processo de rejeição. Antes que o transplante ocorra, os tecidos do receptor e do doador em potencial devem ser analisados para verificar a compatibilidade, ou seja, o grau de semelhança, dos antígenos HLA. Como não é fácil, porém, encontrar um doador compatível, muitas vezes são realizados transplantes em que é parcial a compatibilidade HLA entre o doador e o receptor. O grau de disparidade entre os antígenos da superfície celular do doador e do receptor vai determinar a intensidade das reações de rejeição, que podem ser minimizadas com medicamentos. O uso de células-tronco do sangue de cordão umbilical em transplantes é mais vantajoso do que o de medula óssea, por vários motivos: elas se implantam mais eficientemente, são mais tolerantes à incompatibilidade entre receptor e doador, têm disponibilidade imediata e há possibilidade de realização do transplante sem que o doador seja submetido a qualquer tipo de procedimento cirúrgico.
A facilidade de coleta e da análise prévia de antígenos HLA estimulou a criação de Bancos de Sangue de Cordão Umbilical no Brasil, também coordenados pelo Redome. Esses bancos seguem normas rígidas para coleta, processamento e armazenamento dos tecidos de cordão umbilical, definidas pela Agência Nacional de Vigilância Sanitária (Anvisa), e a coleta só é realizada se a pessoa estiver ciente da gratuidade da doação e autorizar o possível descarte do material após o prazo seguro para sua utilização.
b) em fase de experimentação em humanos
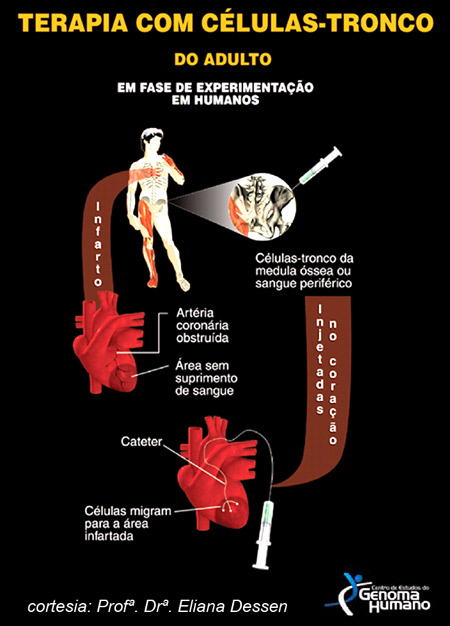
Figura 2
Outra fonte de pesquisas interessante é o tratamento de infartos do miocárdio. Nestes casos, há a morte de parte do tecido cardíaco e as células remanescentes não são capazes de reconstituir o tecido morto. Experimentos indicam que as células-tronco hematopoéticas introduzidas são capazes de migrar para áreas doentes e de originar novas células de músculo cardíaco e de vasos sanguíneos.
O Instituto do Coração (Incor) de São Paulo é um dos hospitais entre poucos outros no país, nos quais estão sendo realizadas aplicações de células-tronco em pacientes com insuficiência cardíaca, causada por doença de Chagas, hipertensão ou de origem desconhecida. Duas técnicas diferentes têm sido utilizadas: a aplicação de células-tronco isoladas da medula óssea e a utilização de um hormônio que estimula a liberação das células-tronco da medula óssea do próprio paciente para a circulação sanguínea – dali as células migram para as áreas lesadas.
As células-tronco também têm sido utilizadas em pesquisas para tratamento de doenças autoimunes, tais como a artrite reumatóide e o lúpus eritematoso sistêmico. Uma equipe do Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto, da USP (HCFMRP-USP), empregou células-tronco de medula óssea, retiradas do próprio paciente e submetidas à quimioterapia, para transplante.
A quimioterapia destrói as células defeituosas do sistema imune. Os resultados foram animadores e estão sendo agora comparados com os resultados obtidos com a terapia convencional, que não envolve células-tronco. Apesar do entusiasmo dos cientistas e da sociedade com os resultados positivos da terapia celular, é importante lembrar que ainda são necessárias muitas pesquisas (compostas de diversas etapas até o estabelecimento de um novo procedimento médico), financiamentos e discussões no campo político, ético e legal. Este é o cenário ideal para o desenvolvimento dessa nova forma de terapia.
A equipe do Centro de Pesquisa Gonçalo Moniz, da Fiocruz Bahia, realizou em 2003 o primeiro transplante de células de medula óssea em pacientes com insuficiência cardíaca causada pela doença de Chagas, procedimento até então inédito no mundo.
II. Terapia com células-tronco embrionárias em fase de experimentação em animais
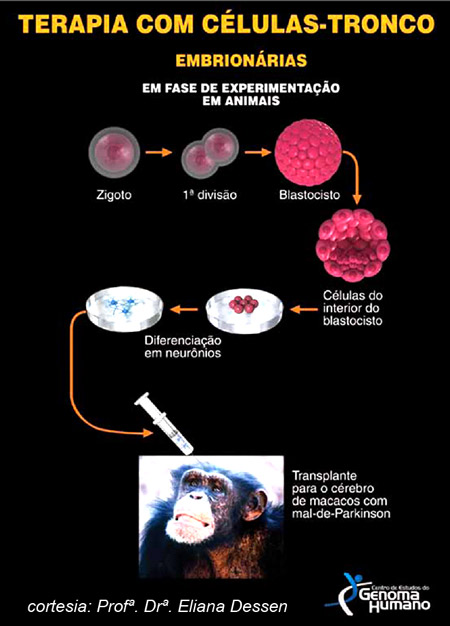
Figura 3
Células IPS- Induced pluripotent stem-cells
Em 2007, dois grupos independentes de pesquisadores liderados por Shinya Yamanaka, da Universidade de Kioto no Japão, e James Thomson, nos Estados Unidos, mostraram que seria possível reprogramar células adultas - fibroblastos retirados da pele - e fazê-las voltar ao estágio de células-tronco embrionárias através da ativação de alguns genes. Essas células reprogramadas foram chamadas de IPS- do inglês induced pluripotent stem-cells. A técnica que foi iniciada em camundongos foi, posteriormente, replicada com células humanas e hoje ela já é rotina em vários laboratórios ao redor do mundo. A grande vantagem dessa estratégia é a de que ela não requer óvulos humanos, que além de difíceis de serem obtidos, estão associados a problemas éticos, tais como o comércio de óvulos. Essa tecnologia que substitui a clonagem terapêutica tem uma aplicação extraordinária em doenças genéticas. Não sabemos ainda se as células IPS poderão ser usadas em terapia celular, mas para pesquisas elas têm um potencial fantástico. A partir da célula de um paciente com uma doença genética, é possível derivar várias linhagens celulares, permitindo estudos que seriam praticamente impossíveis no ser humano. Por exemplo, por que um defeito em um determinado gene afeta um tecido e não outro? Como o gene defeituoso se expressa nos diferentes tecidos? Por que pessoas com a mesma mutação podem ter quadros clínicos tão diferentes? Além disso, as linhagens celulares derivada de células IPS permitem testar diferentes estratégias para corrigir uma mutação genética através de terapia gênica ou agentes farmacológicos.
A descoberta das células IPS foi defendida por muitos como uma alternativa ao uso das CTE. Tomara que isso seja verdade. Entretanto, em 2010, os cientistas ainda estão convencidos de que temos muito ainda a aprender com essas células. Por outro lado, também não podemos acreditar que as células-tronco vão curar todas as doenças humanas. As pesquisas que estão sendo realizadas agora serão fundamentais para responder a questões sobre o potencial das células-tronco adultas em comparação com as embrionárias e as IPS, que doenças poderão ser tratadas e quais são os benefícios e riscos da terapia celular.
Reprogramando células para a pluripotência: células pluripotentes induzidas (iPS)
A primeira derivação de células-tronco embrionárias humanas ocorreu logo após a publicação da primeira clonagem de mamíferos. Embora animais clonados vivos sejam relativamente raros, blastocistos obtidos por transferência de núcleo somático podem ser usados para gerar células-tronco embrionárias em camundongos (Animação 1). Excitamento e controvérsia acompanharam a possibilidade de replicar esse resultado com células humanas: excitamento por causa das perspectivas de uso de células-tronco em terapia personalizada e também pela possibilidade de gerar células-tronco, obtidas de pessoas com doenças genéticas, o que permitiria estudar os mecanismos dessas doenças in vitro; controvérsia por causa da possível conexão com a clonagem reprodutiva humana, os problemas éticos sobre a doação de óvulos, e a deliberada criação e destruição de embriões humanos. Entretanto, embora células-tronco embrionárias de primatas tenham sido obtidas pela técnica da transferência somática de núcleo, nenhum sucesso com células humanas foi relatado até o momento. Mesmo em camundongo, o número de ovócitos necessários para gerar células-tronco pela técnica de transferência de núcleo somático é muito grande. Em humanos, a dificuldade de obtenção de ovócitos em grande número tem sido um impedimento para qualquer progresso real nessa área.
Todo esse quadro mudou em 2006, quando Takahashi e Yamanaka publicaram o primeiro artigo, mostrando que era possível transformar fibroblastos da cauda de camundongos em células que apresentavam muitas das propriedades das células-tronco embrionárias desse organismo, por meio da inserção e expressão, mediada por retrovírus, de quatro genes que codificam fatores de transcrição: Oct4, Sox2, cMyc e Klf4 (Animação 7). Essas células reprogramadas foram denominadas iPS, células pluripotentes induzidas.
Animação 7 - Células reprogramadas
A primeira geração de células iPS era semelhante, e não idêntica às células-tronco embrionárias. Entretanto, em pesquisas posteriores, foram obtidas células iPS com padrão de expressão gênica e padrão epigenético mais semelhantes às células-tronco embrionárias.
Estágios intermediários de reprogramação
A reprogramação induzida de fibroblastos pela adição de fatores de transcrição é um processo gradual, que leva cerca de 2 semanas. Durante esse período, ocorre proliferação celular em cultura, os genes marcadores de fibroblastos são silenciados, enquanto os genes endógenos de pluripotência são progressivamente ativados, ao mesmo tempo em que ocorre o silenciamento dos transgenes inseridos pelo retrovírus. Entretanto, nem todas as células transformadas atingem o estágio final de reprogramação e permanecem num estágio intermediário entre a pluripotência e a célula diferenciada, ou seja, de reprogramação parcial.
Nas células parcialmente reprogramadas, os transgenes retrovirais, que são geralmente usados, não estão silenciados e os genes endógenos característicos de pluripotência mostram um padrão incompleto de desmetilação de seus promotores, estando, portanto, inativos ou com baixos níveis de transcrição.
Avaliação de células iPS
Os pesquisadores ainda não chegaram a um acordo com relação a como avaliar se uma linhagem de células é ou não iPS. O teste mais rigoroso envolve a inserção das células reprogramadas em um embrião de camundongo, implantá-lo numa mãe de aluguel, deixar o camundongo quimérico se desenvolver até o estado adulto, aguardar para ver se o indivíduo produz gametas e se são capazes de produzir descendentes saudáveis. A habilidade de produzir um novo embrião mostra que os parâmetros biológicos das células iniciais foram reprogramados. Tais testes são eticamente inaceitáveis em humanos, de modo que o ensaio-padrão, emprestado das células-tronco embrionárias, envolve a injeção de células humanas em camundongos imunodeprimidos e a espera de seis a oito semanas para verificar se as células formam um teratoma. Teratomas de ocorrência natural podem crescer na forma de vários tecidos diferenciados, inclusive cabelo e osso, mas, para as células transplantadas ganharem o selo iPS, os pesquisadores precisam ver uma massa de células indiferenciadas representando todas as principais classes de tecidos. É comum que células, que parecem totalmente reprogramadas em termos de morfologia e de marcadores de superfície, não formem teratomas.
Emprego de células iPS
O potencial de aplicações das células iPS é enorme, mas a tecnologia está ainda na sua infância. Para perceber todas as possibilidades de aplicação das iPs, é essencial melhorar as metodologias, para geração de células iPS e para avaliar precisamente cada clone e cada subclone quanto à sua eficiência e segurança. As possibilidades de aplicação das células iPs são praticamente as mesmas das células-tronco embrionárias – inclusive o potencial para terapia celular, triagem de drogas e modelo para estudo de doenças – sem a maioria dos problemas éticos apresentados. Grupos ligados a direitos humanos rapidamente sugeriram que células iPS humanas tornaram desnecessárias as pesquisas com células-tronco embrionárias humanas, uma asserção que foi prontamente contestada por Yamanaka, que apontou que células-tronco embrionárias humanas ainda são necessárias para serem usadas como padrão para se medir o progresso no desenvolvimento da tecnologia de desenvolvimento de células iPS.
Aplicadas ao tratamento de doenças humanas, as células iPS são potencialmente mais úteis que as células-tronco embrionárias. Elas podem ser retiradas de um paciente, manipuladas de modo que produza células terapêuticas e, então, ser retornadas para o mesmo indivíduo sem o risco de rejeição. Além disso, células iPS que não conseguem formar teratomas, mas que podem gerar hepatócitos, por exemplo, devem ser melhores para pesquisas relacionadas ao tratamento de doenças do fígado e mais seguras para o uso clínico. Yamanaka acredita que células iPS estarão sendo usadas para triagem de drogas e testes de toxicidade dentro de 3 a 4 anos. As tentativas clínicas devem ocorrer em 10 anos. Quatro diferentes grupos de pesquisa geraram células iPS a partir de células de pacientes com doenças neurodegenerativas.
– esclerose amiotrófica lateral, atrofia musculoespinhal, doença de Parkinson – e de uma variedade de doenças genéticas de herança complexa ou mendeliana. Em camundongo, os pesquisadores já chegaram ao próximo passo, gerando células sanguíneas e nervosas e usando-as para tratar camundongos com anemia falciforme e mal de Parkinson. Células iPS de pacientes com doenças genéticas representam um suprimento sem limites de células para o estudo dessas doenças.
Em camundongos, as quimeras adultas obtidas a partir de células iPS mostram competência para a transmissão da linhagem germinativa; entretanto, as quimeras e seus descendentes frequentemente desenvolvem tumor, os quais, em alguns casos devem ser causados pela reativação do oncogene cMyc. É possível gerar células iPS sem a inserção retroviral de cMyc, porém com baixa eficiência. Além disso, a integração retroviral dos outros fatores de transcrição pode ativar ou inativar genes da célula hospedeira.
O estudo de células iPS é uma oportunidade para esclarecer as funções dos fatores de transcrição, fatores de remodelamento da cromatina e de miRNAs que atuam na pluripotência.