Roteiro da Semana 8
| Site: | Moodle USP: e-Disciplinas |
| Curso: | 04 - Genética e Biologia Molecular |
| Livro: | Roteiro da Semana 8 |
| Impresso por: | Usuário visitante |
| Data: | terça-feira, 2 jul. 2024, 10:18 |
Descrição
Roteiro da semana 8 do curso de Genética e Biologia Molecular.
Introdução
Vídeo de abertura
Os cromossomos
A maioria das células humanas é diploide, isto é, contém duas cópias do genoma humano. O conteúdo de DNA e o número de cromossomos de um genoma são designados por C e n, respectivamente. O conteúdo de DNA das células diploides é 2C e elas têm 2n cromossomos.
Os cromossomos ativos e funcionais observados na interfase (fase que controla as atividades celulares) são estruturas muito mais estendidas e difusas do que os cromossomos estudados durante a divisão celular. Na divisão celular, os cromossomos atingem seu nível máximo de compactação durante a metáfase e, por já estarem duplicados, apresentam-se formados por duas cromátides unidas pelo centrômero. Na metáfase, o grau de compactação atingido pelos cromossomos chega a cerca de 1:10.000 em relação ao seu comprimento quando em completo relaxamento.
Considerando-se os cromossomos como organelas funcionais, estes apresentam três classes de elementos com sequências de DNA: centrômeros, telômeros e origens de replicação (Animação 1).
Animação 1: Morfologia e classificação dos cromossomos humanos. As setas indicam as diferentes regiões que compõem o cromossomo.
Os cromossomos podem ser identificados pelo seu tamanho, pela posição do centrômero e pelo padrão de bandamento (Animação 2).
Animação 2: Morfologia e classificação dos cromossomos humanos. Representação dos diferentes tipos de cromossomos.
O cariótipo humano
A constituição cromossômica de uma célula é descrita por um cariótipo, que informa o número total de cromossomos e a constituição quanto aos cromossomos sexuais. As fêmeas e os machos humanos têm, respectivamente, 46, XX e 46, XY. Quando existe uma anomalia cromossômica, o cariótipo também descreve seu tipo, e as bandas e sub-bandas afetadas. Depois da aplicação das técnicas de preparo dos cromossomos, é necessário, para a sua análise, que eles sejam organizados, com o pareamento dos cromossomos homólogos e sua classificação que leva em conta o tamanho, número e morfologia. Pode-se também representar por esquema cada tipo de cromossomo de uma célula (conjunto haploide) ao que se denomina ideograma.
Os cromossomos humanos foram classificados em 7 grupos, de acordo com o tamanho e a posição do centrômero. Dependendo da posição do centrômero, pode-se diferenciar um braço curto denominado p (do francês petit) e um longo chamado q (do francês queue). O quadro a seguir apresenta um resumo da constituição do cariótipo humano.
| GRUPO | CROMOSSOMO | DESCRIÇÃO |
| A | 1,2,3 | Os maiores, 1 e 3 são metacêntricos, 2 é sub-metacêntrico. |
| B | 4,5 | Grandes, submetacêntricos, com os dois braços muito diferentes em comprimento. |
| C | 6-12,X | Tamanho médio, submetacêntricos. |
| D | 13-15 | Tamanho médio, acrocêntricos com satélites. |
| E | 16-18 | Pequenos. 16 é metacêntrico, 17 e 18 são submetacêntricos. |
| F | 19,20 | Pequenos, metacêntricos. |
| G | 21,22,Y | Pequenos, acrocêntricos, com satélites no 21 e 22, mas não no Y. |
Até recentemente, o cariótipo era montado a partir de fotos das células em metáfase mitótica presentes nas lâminas com preparações cromossômicas. Para a montagem do cariótipo, os cromossomos de cada célula eram recortados e organizados em ordem decrescente de tamanho, de acordo com sua morfologia. Atualmente, existem programas de análise de imagens por computador, que capturam a imagem dos cromossomos de uma célula, organizam-nos conforme o tamanho, a posição do centrômero e o padrão de bandamento (Animação 3).
Animação 3: Representação dos diferentes tipos de cromossomos.
Os cromossomos só podem ser vistos por microscopia óptica, em células que estejam se dividindo, mas obter estas células em divisão diretamente do corpo humano é difícil. A medula óssea é uma possível fonte, porém, envolve procedimentos invasivos e, por vezes, de risco. A obtenção de células a partir do sangue e o seu cultivo em laboratório envolvem técnicas relativamente simples. A única dificuldade era induzir a divisão celular, uma vez que as células do sangue periférico perderam a capacidade de se dividir. Para esse fim, foi utilizada uma substância extraída do feijão, a fito-hemaglutinina, que em condições apropriadas, permite que os linfócitos T se dividam. Glóbulos brancos do sangue são colocados em um meio de cultura por 48 a 72 horas, quando deverão se dividir livremente. O índice mitótico é aumentado quando a cultura é tratada com um agente desagregador do fuso, a colchicina. Dessa forma, as células atingem a fase de metáfase do ciclo, mas não conseguem sair dela; portanto, acumulam-se células nessa etapa mitótica, na qual os cromossomos duplicados constituídos por duas cromátides unidas pelo centrômero atingem seu maior grau de condensação, permitindo a sua análise.
As técnicas de bandamento cromossômico longitudinal (bandas G e R) evidenciam faixas transversais ao longo das cromátides (Animação 4); elas permitem a identificação individual de cada cromossomo, bem como a localização dos pontos de quebra em rearranjos cromossômicos do tipo translocações, deleções etc. Vários tratamentos que envolvem desnaturação e/ou digestão enzimática, seguida de incorporação de corantes de DNA específicos, podem fazer com que os cromossomos se corem, revelando uma série de bandas claro-escuras. O padrão de bandas de cada cromossomo proporciona evidências de algum tipo de estrutura superior à das regiões de 1 a 10 Mb.
Animação 4: Técnica de bandamento cromossômico G; evidenciando faixas transversais nas cromátides; elas permitem a identificação individual de cada cromossomo, bem como a localização dos pontos de quebra em rearranjos cromossômicos do tipo translocações, deleções, etc.
Anomalias cromossômicas
Qualquer alteração no cariótipo humano geralmente determina mudanças morfológicas e/ou fisiológicas, a não ser que ela ocorra em regiões desprovidas de informação genética.
As aberrações ou anomalias cromossômicas podem ser classificadas em numéricas e estruturais, que incluem, respectivamente, alterações em número ou em estrutura. Em muitos casos, as aberrações cromossômicas são incompatíveis com a sobrevivência do indivíduo afetado (Animação 5).
| Alterações | - | Síndrome (cromossomo) |
| Trissomias autossômicas | - | Síndrome de Down (21), Síndrome de Edwards (18), Síndrome de Patau (13) |
| Deleção | - | Síndrome de Wolf-Hirschhorn (4), Cri du chat (5), Síndrome de Williams (7), Imprinting genômico. Síndrome de Angelman/Síndrome de Prader-Willi (15), Síndrome de Miller-Dieker/Síndrome de Smith-Magenis (17), Síndrome da deleção 22q11.2 (22). |
| - | Monossomia | Síndrome de Turner (XO) |
| Ligados ao X/Y | Trissomia | Síndrome do triplo X (XXX), Síndrome de Klinefelter (XXY), Duplo Y (XYY) |
| - | Outros cariótipos | XXXX, XXYY, XXXXX, XXXXY |
| Translocações | - | Cromossomo Filadélfia, Linfoma de Burkitt |
Tabela 2: No quadro, são mostradas algumas alterações estruturais e as respectivas síndromes e/ou os cromossomos envolvidos.

Figura 1: Frequência de doenças cromossômicas em recém-nascido (RN).
Trissomia cromossômica
Trissomia é um tipo de mutação cromossômica numérica, que apresenta uma cópia extra (total ou parcial) de um ou mais (trissomia dupla, tripla) cromossomos do cariótipo. Como exemplo de trissomia na espécie humana, vamos considerar a síndrome de Down.
Síndrome de Down ou trissomia do cromossoma 21 é a doença genética mais comum, afetando 1 em cada 800 nascimentos. É causada pela presença de um cromossomo 21 extra, total ou parcial. A síndrome é caracterizada por atraso no desenvolvimento neuropsicomotor e pelos sinais faciais típicos, que permitem a sua identificaçao já ao nascimento. (Animação 6).
Animação 5: Síndrome de Down ou trissomia do cromossoma 21. A síndrome é caracterizada por atraso no desenvolvimento neuropsicomotor e pelos sinais faciais típicos, que permitem a sua identificação já ao nascimento.
Pessoas com síndrome de Down apresentam, geralmente, uma habilidade cognitiva abaixo da média, variando de retardo mental leve a moderado, podendo também ter retardo mental profundo. Muitas das características comuns da síndrome de Down incluem a prega palmar transversa (uma única prega na palma da mão, em vez de duas), olhos com formas diferenciadas devido às pregas nas pálpebras, membros pequenos, tônus muscular pobre e língua protrusa. Os afetados pela síndrome de Down apresentam maior incidência de defeitos cardiacos congênitos, alterações gastroesofágicas, apneias e disfunções hormonais.
A síndrome de Down ocorre em todas as raças e classes sociais, pois é causada por um erro na divisão dos cromossomos durante a gametogênese. Na trissomia do cromossomo 21 simples, que ocorre em 95% dos casos, a criança apresenta três cópias do cromossomo 21.
Animação 6: Cariótipo com trissomia do cromossomo 21.
O erro geralmente ocorre por uma não-disjunção meiótica, sendo que em 8% dos casos a não-disjunção ocorreu no gameta paterno e em 88% dos casos, na meiose materna. A frequência desse tipo de erro aumenta com a idade materna, sendo esta uma das razões do aumento de risco de nascimento de criança com síndrome de Down em mulheres acima dos 35 anos (Figura 2).
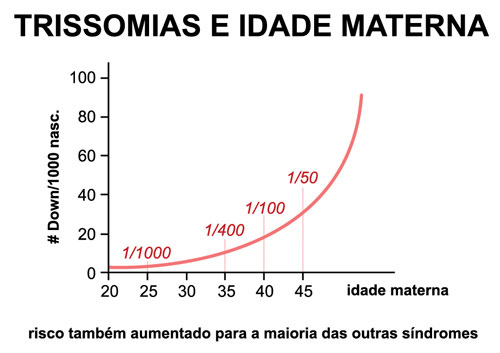
Figura 2: Trissomias e idade materna.
Em ~4% dos casos de síndrome de Down, o material extra é proveniente de uma translocação Robertsoniana, onde o braço longo do cromossomo 21 está ligado a outro cromossomo acrocêntrico (cromossomos 13, 14, 15, 21 ou 22), podendo haver assim variabilidade na região extra. A mutação pode ser uma mutação de novo ou pode ser herdada de um dos progenitores que não apresenta a doença por ter uma translocação Robertsoniana em forma equilibrada (Animação 7). Alem disso, cerca de 1-2% dos pacientes com sindrome de Down são mosaicos, geralmente com um cariótipo formado por uma população de células normais, ou com trissomia do 21. Nestes casos, o fenótipo pode ser mais brando do que o de uma trissomia do 21 típica (porem muito variável).
Animação 7: Síndrome de Down
Monossomia cromosômica
Monossomia é um tipo de aberração cromossômica numérica, na qual está presente apenas um elemento de determinado par cromossômico. Assim sendo, nas células diploides, em vez de dois representantes de cada tipo de cromossomo, no par afetado existe apenas um elemento. Há exemplos de monossomias em algumas espécies animais e vegetais, mas, na espécie humana, as monossomias autossômicas impedem a sobrevivência de seus portadores e são achados frequentemente em abortos e natimortos.
Síndrome de Turner afeta 1 em cada 5.000 meninas. É a única monossomia cromossômica compatível com a vida. A síndrome de Turner é causada pela falta de um dos cromossomos X, em virtude de uma não-disjunção durante a formação dos gametas. A constituição cromossômica mais frequente é 45, X (45 cromossomos com falta de um cromossomo X), não havendo a presença de cromatina sexual nos núcleos das células somáticas; há também relatos de pacientes Turner com monossomias parciais (Animação 8).
Animação 8 - Síndrome de Turner
A síndrome pode ser identificada ao nascimento ou antes da puberdade, por suas características fenotípicas distintivas. As meninas apresentam baixa estatura, pescoço alado (com pregas cutâneas bilaterais), má-formação das orelhas, tórax largo em barril, órgãos sexuais (ovários e vagina) e caracteres sexuais secundários (seios) poucos desenvolvidos, maior frequência de problemas renais e cardiovasculares. Quase sempre as portadoras da síndrome são estéreis. O diagnóstico pode ser feito em qualquer idade; cerca de 30% das crianças são diagnosticadas ao nascimento e outras 25%, durante o período médio da infância. Para muitas meninas portadoras de Síndrome de Turner, entretanto, o diagnóstico pode ser feito somente na adolescência. Há indicação para tratamento hormonal a partir da puberdade.
Deleção cromossômica
A deleção ou deficiência é um tipo de mutação cromossômica estrutural que resulta na perda de um segmento terminal (uma só quebra) ou intercalar (duas quebras). Nesse tipo de mutação, são produzidos fragmentos cromossômicos acêntricos (sem centrômero), que serão perdidos durante a divisão celular por não se ligarem às fibras do fuso, e segmentos cêntricos (com centrômero), que serão mantidos durante o ciclo celular.
Alguns exemplos de deficiências causadas por deleções cromossômicas no homem são:
Síndrome Cri-du-Chat, que é causada pela deleção de parte do braço curto do cromossoma 5. Os pacientes apresentam um choro agudo, que se assemelha ao miado de um gato. Têm os olhos afastados, cabeça e maxilar pequenos e retardo mental (Animação 9).
Animação 9: Deleção cromossômica; síndrome do Cri Du Chat e características clínicas.
Doenças mendelianas
As doenças genéticas são caracterizadas pela presença de alterações no DNA que levam a uma falha no funcionamento do organismo. Elas podem ser hereditárias e, nesse caso, serâo transmitidas de geração em geração.
As doenças hereditárias podem ser causadas por mutações em um único gene, denominadas monogênicas ou mendelianas, ou podem ser causadas pela combinação de múltiplos fatores ambientais e mutações em vários genes, geralmente localizados em diferentes cromossomos (Animação 10).
Animação 10: Doenças infecciosas, multifatoriais e genéticas.
Atualmente, já são conhecidas mais de 6.000 doenças monogênicas, com uma prevalência de 1 a cada 200 nascimentos. As doenças monogênicas transmitem-se segundo os padrões hereditários mendelianos.
Herança Autossômica Recessiva
Para que a doença se manifeste, precisa-se de duas cópias do gene mutado no genoma da pessoa afetada. Os pais normalmente não manifestam a doença, mas portam cada um uma cópia do alelo mutado, podento transmitir a mutaçao à descendência. A probabilidade de ter um filho afetado por uma doença autossômica recessiva entre duas pessoas portadoras de uma só cópia do alelo mutado é de 25% (Animação 11).
Animação 11: Características da herança autossômica recessiva.
Exemplo de doença de herança autossômica recessiva
A Fenilcetonúria (PKU – PhenylKetonUria) é uma doença genética caracterizada pelo defeito ou ausência da enzima fenilalanina hidroxilase (PAH). A PKU afeta aproximadamente um em cada dez mil indivíduos da população caucasiana. As pessoas com PKU possuem mutação nos dois alelos do gene da PAH, que mudam ou impedem a função da enzima. Mutações diferentes têm efeitos diversos na enzima. Quando não tratada preventivamente logo ao nascimento, os sintomas da doença aparecem ao redor de um ano de vida e consistem em: oligofrenia, atraso no desenvolvimento psicomotor (andar ou falar), convulsões, hiperatividade, tremor e microcefalia. Praticamente todos os pacientes não tratados apresentam um QI inferior a 50. Essa doença pode ser detectada logo ao nascimento através da triagem neonatal efetuada com o chamado “teste do pezinho”. Quando identificada a alteração, a criança pode ser logo tratada com uma dieta especial, pobre em fenilalanina, que previne o aparecimento dos sintomas (Animação 12).
Animação 12: Fenilcetonúria. Obs.: RM (retardo mental)
Herança Autossômica Dominante
Só é necessária uma cópia do alelo mutado do gene para que a pessoa manifeste os sintomas de uma doença autossômica dominante. Um dos dois progenitores de uma pessoa afetada pode manifestar a doença e estes progenitores têm 50% de probabilidade de transmitir o gene mutado a seu descendente, que será afetado. Em muitas doenças dominantes com quadro grave, os pacientes afetados são casos únicos, pois a doença ocorreu por causa de uma mutaçao nova no gene. Nestes casos, nao há risco de recorrência da doença em uma próxima criança (Animação 13).
Animação 13: Herança autossômica dominante.
Exemplo de doença de herança autossômica dominante
Acondroplasia é a forma mais comum de nanismo rizomélico, ocorrendo em 1 em cada 15.000 recém-nascidos (Animação 14). Mais de 80% dos casos são esporádicos, causados por mutações novas. Nos casos herdados, um dos genitores apresenta também a acondroplasia. Nestes casos, o risco de transmitir o alelo mutado para a sua prole é de 50%. A acondroplasia é consequência de uma mutação no gene que codifica o receptor do fator de crescimento fibroblástico 3 (FGFR3 ). Mais de 97% dos pacientes com acondroplasia apresentam a mesma mutação nesse gene, o que permite um diagnóstico molecular rápido e fácil.
Animação 14: Acondroplasia.
Herança Ligada ao Cromossomo X
O alelo mutado localiza-se no cromossomo X e pode ser transmitido de forma dominante ou recessiva. Os homens afetados transmitem seu único cromossomo X com a mutação para todas as filhas, que serão portadoras assintomáticas, no caso de mutações recessivas. Estas têm um risco de 50% de transmitir a mutação para a sua prole, sendo que se forem meninos serão afetados (Animações 15 e 16).
Animação 15: Características dos cromossomos sexuais.
Exemplo de doença de herança ligada ao X
A distrofia muscular progressiva de Duchenne (DMD) é uma doença genética de herança recessiva ligada ao cromossomo X, que afeta predominantemente indivíduos do sexo masculino (Animação 17). A DMD é causada por mutações no gene da proteína distrofina, que levam à ausência desta proteína na membrana das fibras musculares dos pacientes afetados. Clinicamente, a DMD é caracterizada pela degeneração progressiva e irreversível da musculatura esquelética, levando a uma fraqueza muscular generalizada .
Animação 16: Herança recessiva ligada ao cromossomo X.
A DMD é a forma mais frequente de distrofia, afetando 1 a cada 3.500 nascimentos masculinos. Clinicamente, os primeiros sinais de fraqueza muscular são identificados quando a criança começa a andar, tornando-se mais evidentes ao redor dos 3 anos de idade, com quedas frequentes, dificuldades para subir escadas, para se levantar do chão e correr. A fraqueza é progressiva, levando à perda da marcha ao redor dos 10 anos de idade e à morte, na segunda ou início da terceira década de vida, por insuficiência respiratória ou cardíaca (Animação 17).
Animação 17: Características clínicas da Distrofia muscular de Duchenne.
As meninas não manifestam a doença, uma vez que o seu cromossomo X portador da mutação será compensado pelo produto do alelo normal, presente no outro cromossomo X. Entretanto, poderão transmitir a mutação para a sua prole com 50% de chance; quando seu cromossomo X mutado é transmitido a uma filha, ela passará a ser portadora; e quando transmitido a um filho, ele manifestará a doença. Os meninos, por possuírem apenas um cromossomo X, proveniente da mãe, e um cromossomo Y, proveniente do pai, não se beneficiam do mecanismo de compensação de dose; visto que seu único cromossomo X é portador da mutação e como esta leva à ausência de produção da proteína, os meninos terão deficiência total desta importante proteína no músculo, manifestando a doença.
Vídeo 2
Padrões de herança mendeliana
Animação 18 - Quadro baseado em Strachan & Read, 2002.
Doenças multifatoriais
São um conjunto de doenças hereditárias causadas pela combinação de múltiplos fatores ambientais e mutações em vários genes, geralmente, localizados em diferentes cromossomos. Por exemplo, sabe-se que múltiplos genes influem na suscetibilidade de apresentar câncer de mama: sabe-se de genes localizados nos cromossomos 6, 11, 13, 14, 15, 17 e 22. Devido a esse conjunto de causas complexas, as doenças multifatoriais são bem mais difíceis de analisar do que as doenças monogênicas ou as alterações cromossômicas. Algumas das doenças crônicas mais frequentes são multifatoriais, como, por exemplo: Hipertensão arterial, Doença de Alzheimer, Diabetes mellitus e vários tipos de câncer
Aconselhamento genético
Um aspecto extremamente importante no atendimento aos pacientes com alguma doença genética hereditária é o diagnóstico precoce, que permite o aconselhamento genético preciso. Este deve oferecer as informações necessárias para prevenir e tratar as complicações mais frequentes nessas doenças, e ajudar na tomada de decisões reprodutivas.
O primeiro ponto importante para o aconselhamento genético é a definição do diagnóstico. Nesse sentido, os testes genéticos vêm ganhando um grande destaque. Uma das aplicações mais óbvias das informações geradas pelo Projeto Genoma Humano (PGH) está em prever e diagnosticar doenças genéticas. Várias centenas de testes genéticos estão disponíveis e seu número deverá aumentar significativamente na próxima década. Atualmente, já estão disponíveis os testes genéticos para detectar mutações em doenças genéticas hereditárias, como fibrose cística, doença de Huntington, distrofia muscular de Duchenne e anemia falciforme. Esses testes não detectam todas as mutações associadas à doença, mas grande parte das mutaçoes mais frequentes associadas a cada doença. Com as informações adicionais fornecidas pelo PGH, vem crescendo o potencial para detectar mutações ainda desconhecidas.
Além disso, alguns testes genéticos que permitem que os indivíduos monitorem ou evitem certos tipos de câncer também já se tornaram disponíveis recentemente. Dada uma história familiar de câncer de mama, câncer do cólon ou câncer de ovário, os indivíduos podem optar por serem examinados quanto à presença ou ausência de mutações preditivas no seu genótipo. As informações obtidas a partir desses testes preditivos podem ajudar médicos e pacientes a controlar e prevenir o aparecimento da doença.
Uma vez alcançada a definição exata do tipo de doença genética, o aconselhamento genético segue os princípios básicos de herança autossômica dominante ou recessiva.
Nas doenças autossômicas recessivas, os pais geralmente são portadores heterozigotos de uma das mutações. Quando há consangunidade, os pais terão a mesma mutação herdada de um ancestral comum. Portanto, para os pais de uma criança com uma comprovada forma de doença autossômica recessiva, há um risco de recorrência de 25% para um futuro filho do casal ser afetado pela mesma doença (e portador da mesma mutação). Irmãos e irmãs da pessoa afetada terão 2/3 de chance de serem portadores. Outros membros da família também podem ser portadores de um alelo mutado; no entanto, para estes parentes, é baixo o risco de uma prole afetada, pois a maioria das mutações recessivas são muito raras e é muito baixa a probabilidade de um portador da mutação escolher, ao acaso na população geral, um parceiro também portador da mesma mutação. O risco de ter outra criança afetada é aumentado em populações com efeito do fundador e onde haja consanguinidade. Portanto, um aconselhamento genético específico e cuidadoso é necessário e deve explicar os riscos nessas situações.
Nas doenças de herança autossômica dominante, quando uma família de muitos membros e com sinais clínicos óbvios é diagnosticada, o aconselhamento genético é mais evidente. Indivíduos afetados têm risco de 50% de transmitir a doença para a sua prole. Em casos em que é possível identificar a mutação causal, podem-se oferecer testes preditivos e diagnóstico pré-natal para a doença. Há, entretanto, várias situações em que o aconselhamento genético pode ser mais complexo. Em alguns casos, as mutações dominantes podem ser não-penetrantes ou podem causar doenças de manifestação tardia, o que pode complicar o diagnóstico. Em muitas doenças de herança autossômica dominante, mutações raras de sentido trocado podem não deixar evidente a determinação de sua patogenicidade. Também pode ser difícil fornecer uma previsão de prognóstico. Para a maioria das doenças deste grupo, a possibilidade e a importância de um diagnóstico pré-clínico também devem ser cuidadosamente analisadas. Um diagnóstico pré-clínico geralmente é recomendado apenas quando é possível alguma prevenção clínica das complicações, ou se esta informação é importante para as decisões reprodutivas. Nesses casos, o paciente deve ser muito bem apoiado, psicológica e clinicamente. Com a definição do diagnóstico e identificação das mutações causadoras, o diagnostico pré-natal também é possível e as opções para o diagnóstico pré-implantação podem ser discutidas com a família, de acordo com a disponibilidade local.
As doenças de herança ligada ao X se caracterizam por afetar predominantemente indivíduos do sexo masculino. O alelo mutado pode ser transmitido por mães portadoras que são assintomáticas, quando a doença é recessiva. Essas mulheres portadoras têm um risco de 50% de transmitir a mutação para um filho do sexo masculino, e 50% de transmitir para uma filha, que será também portadora. Quando o paciente afetado chega a se reproduzir, ele irá transmitir o alelo mutado para todas as suas filhas, que serão portadoras. Nenhum dos filhos será afetado, visto que recebe do pai o cromossomo Y.
Na espécie humana, inúmeros genes situados no cromossomo X causam doenças, quando mutados. Dentre eles, podemos citar os relacionados ao daltonismo, hemofilia e distrofia muscular progressiva de Duchenne.
Vídeo 3
Bibliografia
WILLIAM S. KLUG, MICHAEL R. CUMMINGS, CHARLOTTE A. SPENCER e MICHAEL A. PALLADINO. Conceitos de Genética. 9ª EDIÇÃO. Editora: Artmed®. 2009.
WATSON J.D. RICHARD M. MYERS. CAUDY AMY A. WITKOWSKI, JAN A. DNA Recombinante - Genes e Genomas. 3ª EDIÇÃO. Editora: Artmed®. 2009.
STRACHAN T. e READ P.A. Genética Molecular Humana. 2ª EDIÇÃO Editora: Artmed®. 2002.
TURNPENNY P. ELLARD S. Emery Genética Médica. 13ª EDIÇÃO. Editora: Elsevier. 2008.
BRUCE ALBERTS, ALEXANDER JOHNSON, JULIAN LEWIS, MARTIN RAFF, KEITH ROBERTS e PETER WALTER. Biologia molecular da célula. 4ª Edição. Editora: Artmed®. 2008.
[Atividade] - Questionário
![]()
![]() Para dar sequência às atividades - questionário com 1 (uma) questão, clique aqui.
Para dar sequência às atividades - questionário com 1 (uma) questão, clique aqui.