Texto 5 – Organelas Oxidativas: Mitocondrias e Peroxissomos
| Website: | Moodle USP: e-Disciplinas |
| Kurs: | 01 - Biologia Celular |
| Buch: | Texto 5 – Organelas Oxidativas: Mitocondrias e Peroxissomos |
| Gedruckt von: | Gast |
| Datum: | Donnerstag, 11. Juli 2024, 01:55 |
Beschreibung
Texto 5 – Organelas Oxidativas: Mitocondrias e Peroxissomos
Inhaltsverzeichnis
- 1. Iniciando a conversa
- 2. A mitocôndria
- 3. A compartimentalização da mitocôndria
- 4. O processo de geração de ATP
- 5. O DNA mitocondrial
- 6. O peroxissomo
- 7. O Glioxissomo – um peroxissomo com função específica
- 8. O peroxissomo e o metabolismo celular oxidativo
- 9. Como se originam os peroxissomos?
- 10. Doenças associadas aos peroxissomos
- 11. Bibiografia
- 12. Mãos à obra
1. Iniciando a conversa
Os objetivos específicos do Primeiro Tópico do Tema 3 são:
- Identificar a estrutura e as funções da mitocôndria;
- Entender o processo de geração de ATP;
- Identificar a estrutura e as funções do peroxissomo;
- Compreender a origem e as doenças associadas aos peroxissomos.
Nesta semana, vamos estudar duas importantes organelas citoplasmáticas, a mitocôndria e o peroxissomo.
A mitocôndria é uma das organelas mais conhecidas e mais detalhadas pelos livros didáticos, incluindo aspectos morfológicos e bioquímicos. Em contraposição, temos o peroxissomo, pouquíssimo conhecida e, quase sempre, negligenciada pelos livros didáticos. Entretanto, como veremos na aula desta semana, ela possui uma função vital em nossas células, principalmente no fígado. A disfunção destas desconhecidas organelas causa diversas doenças gravíssimas, que resultam em indivíduos bastante debilitados e que dificilmente sobrevivem por muito tempo.
Antes de falarmos da mitocôndria, vamos fazer a leitura desta reportagem: http://www.agencia.fapesp.br/materia/10980/divulgacao-cientifica/troca-de mitocondria.htm .
Normalmente, associamos a mitocôndria apenas ao processo de respiração celular, mas a reportagem nos indica outro encaminhamento possível para iniciarmos as aulas no Ensino Médio de forma a chamar a atenção dos estudantes. Muito interessante, não é?
Além disso, as mitocôndrias possuem características bastante peculiares, como a presença de um DNA próprio, muito semelhante ao das bactérias. Como isso será possível?
Deste modo, vamos saber mais sobre estas organelas oxidativas. Afinal, o que são organelas oxidativas?
Convidamos você a descobrir explorando as webaulas.
Bom estudo!
2. A mitocôndria
A mitocôndria é uma organela citoplasmática presente em todas as células eucariontes, tanto animais quanto vegetais, e, nas primeiras, é a principal responsável pela produção de energia utilizável pela célula, na forma de ATP (adenosina trifosfato). Morfogicamente, a mitocôndria tem uma forma de charuto e em cortes ultra-finos observados ao microscópio eletrônico, apresenta-se limitada por uma dupla membrana, delimitando dois compartimentos: um compartimento externo (entre membranas) e um interno (a matriz) (Fig. 1).
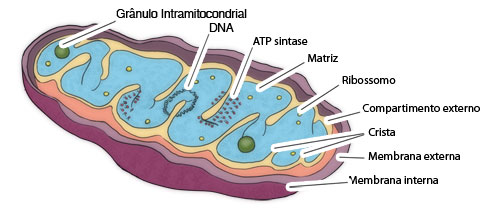
Figura 1: Esquema geral da morfologia de uma mitocôndria em corte longitudinal. Note a ocorrência de duas membranas (externa lisa e interna formando cristas) que delimitam dois compartimentos (externo e matriz).
Fonte: DE ROBERTIS, E.D.P.; DE ROBERTIS, E.M.F. Jr. Cell and molecular biology. 2nd Ed. Saunders College, Philadelphia. 1980.
A membrana externa é lisa enquanto que a membrana interna apresenta-se dobrada (cristas) na forma de septos que se projetam para a matriz. Uma peculiaridade desta organela é a presença de um genoma próprio, na forma de uma pequena molécula circular de DNA na matriz, ligada a uma crista. Normalmente existem mais de uma cópia idêntica desse DNA por mitocôndria.
Além do DNA, a matriz mitocondrial possui todo o maquinário de síntese protéica, incluindo pequenos ribossomos e as diversas formas de RNAs. A mitocôndria é pois capaz de codificar e sintetizar umas poucas proteínas (menos de 1% do total), que constituem algumas das sub-unidades de proteínas integrantes da membrana interna. Todas as demais proteínas da organela são sintetizadas no citossol e importadas para o seu interior.
Existem dois complexos protéicos principais, um na membrana externa da mitocôndria (denominado complexo TOM) e outro na membrana interna (denominado TIM), que formam poros seletivos que estão envolvidos na tomada e direcionamento das proteínas para as duas membranas e compartimentos da organela (externo e matriz). Essas proteínas têm determinadas sequências de sinalização que são reconhecidas por outras proteínas citossólicas e dirigidas para os complexos de transporte na mitocôndria. Para passarem pelos poros dos complexos, as proteínas são desdobradas e readquirem, posteriormente, sua conformação original após a passagem.
Um aspecto importante da mitocôndria é que se trata de uma organela extremamente dinâmica. A observação de células vivas mostra mitocôndrias movendo-se pelo citoplasma (com o auxílio do citoesqueleto), sofrendo processos de fusão e separação, continuamente.
Para saber mais sobre a Movimentação da mitocôndria pelo citossol por interação com o citoesqueleto (microtúbulos), assista a animação abaixo: Animação
Sem as mitocôndrias, as células eucariontes animais teriam que depender da glicólise anaeróbica para a geração de energia (ATP). Contudo, tal processo, que quebra moléculas de glicose em piruvato no citossol, é capaz de liberar apenas uma pequena parte da energia disponível da oxidação de açúcares. Nas mitocôndrias, o metabolismo de açúcares (e ácidos graxos) é completado com sua oxidação, pelo oxigênio molecular (O2), a CO2 e H2O. A energia liberada é captada de forma bastante eficiente, uma vez que 36 moléculas de ATP são produzidas por cada molécula de glicose, enquanto a glicólise sozinha produz apenas duas moléculas de ATP.
3. A compartimentalização da mitocôndria
Bioquimicamente, a mitocôndria é extremamente compartimentalizada. Suas membranas externa e interna são, realmente, bem diferentes. A membrana externa, por exemplo, é muito permeável, até mesmo a pequenas proteínas, graças a uma proteína de canal denominada de porina.
Já a membrana interna é muito pouco permeável e a passagem de substâncias entre o citossol e a matriz depende de proteínas de transporte muito seletivas. Além das proteínas de transporte, a membrana interna possui os chamados complexos enzimáticos respiratórios, formados por dezenas de proteínas integrantes de membrana que se agrupam em três complexos principais (Fig. 2, 3). A membrana interna possui ainda um complexo protéico extremamente importante que é a ATP sintase, responsável, como veremos, pela síntese final de ATP pela mitocôndria.
Na matriz mitocondrial, por outro lado, encontram-se, além do DNA e do maquinário de síntese protéica, praticamente todas as enzimas (exceto uma) que catalizam as várias reações do ciclo dos ácidos tricarboxílicos (ciclo de Krebs), da β-oxidação dos ácidos graxos, além dos complexos enzimáticos que constituem a piruvato desidrogenase.
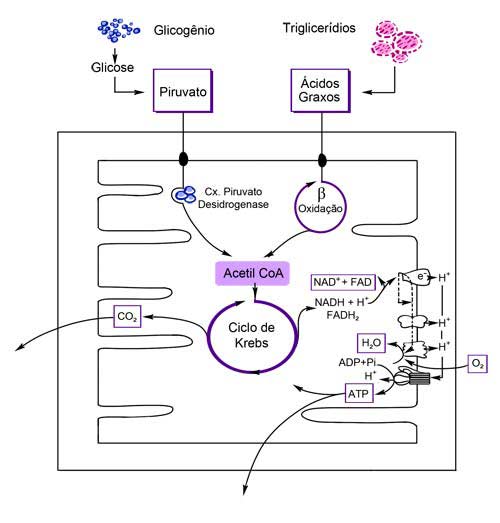
Figura 2: Principais vias metabólicas da mitocôndria. O piruvato (proveniente da quebra do glicogênio) e os ácidos graxos (oriundos dos triglicerídios) são convertidos a acetil CoA, respectivamente, via complexo pirtuvato desidrogenase e β-oxidação. A acetil CoA alimenta o ciclo de Krebs, gerando coenzimas reduzidas e liberando CO2. Finalmente, os elétrons de alta energia presentes nas coenzimas reduzidas são transferidos para os complexos enzimáticos respiratórios produzindo um gradiente de prótons que, através da ATP sintase, é convertido em ATP.
Fonte: Original
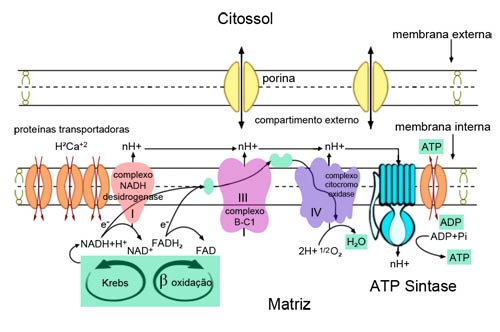
Figura 3: Detalhe das membranas da mitocôndria. A membrana externa é bastante permeável e pouco seletiva, devido à presença de proteínas de canal, as porinas. Em contraposição, a membrana interna é bastante seletiva e comporta, também, outras proteínas, tais como transportadores específicos e os complexos enzimáticos repiratórios. Estes complexos são responsáveis pela geração de ATP, em uma sequência de reações de oxirredução denominada fosforilação oxidativa.
Neste processo, elétrons de alta energia provenientes das coenzimas reduzidas passam por três complexos enzimáticos, que utilizarão sua energia para bombear íons H+ da matriz para o compartimento externo.
A primeira estação da cadeia de transporte de elétrons é formada pelo complexo NADH desidrogenase, que recebe os elétrons das moléculas de NADH + H+ e os passam para uma molécula aceptora, a coenzima Q (que também recebe elétrons diretamente do FADH2). Estes elétrons passam da coenzima Q para o complexo b-c1, que, por sua vez, são transferidos para outra molécula aceptora, o citocromo c. Finalmente, estes elétrons chegam ao último complexo enzimático, o complexo citocromo oxidase, sendo, em seguida, transferidos para o oxigênio, formando água. A energia dos elétrons é convertida pelos complexos enzimáticos em um gradiente eletroquímico de prótons bombeados da matriz para o compartimento externo que, ao retornarem à matriz pela ATP sintase, levam à produção de ATP.
4. O processo de geração de ATP
Em termos funcionais, tanto os carboidratos estocados como glicogênio quanto os lipídios, armazenados no mesmo local na forma de triglicerídios, são convertidos em moléculas de acetil coenzima A, que possui dois carbonos (Fig. 2). Assim, a glicose é convertida em piruvato, que entra na matriz mitocondrial e é transformado em acetil coenzima A pelo complexo piruvato desidrogenase.
Os ácidos graxos, derivados dos triglicerídios, são, por sua vez, igualmente convertidos em acetil coenzima A pela β-oxidação. A acetil coenzima A é totalmente oxidada em CO2 e H2O pelo ciclo de Krebs, gerando coenzimas reduzidas (NADH+H+ e FADH2), cujos elétrons de alta energia são transferidos para os complexos enzimáticos respirátórios, por onde passam sequencialmente até se combinarem com o O2 gerando H2O. A β-oxidação também produz coenzimas reduzidas.
Ao longo da sua passagem pelos complexos, os elétrons perdem energia que é por eles utilizada para bombear prótons (H+) para fora da matriz. Cria-se assim um gradiente eletroquímico através da membrana interna da mitocôndria, que tende a se reequilibrar em ambos os compartimentos. A ATP sintase é a única passagem possível dos prótons para dentro da matriz. Ao passarem por este complexo, os prótons são capazes de mudar sua conformação, produzindo moléculas de ATP, a partir de ADP e fosfato, na matriz mitocondrial. Assim, o ATP é produzido indiretamente como consequência de um gradiente de prótons gerado pelos complexos respiratórios com a passagem de elétrons de alta energia.
É interessante que este gradiente de prótons também fornece energia (ao invés de ATP) para várias proteínas transportadoras que existem na membrana interna, e que transportam substâncias importantes para a mitocôndria, como ADP, fosfato, cálcio e muitas outras (Fig. 3).
5. O DNA mitocondrial
A presença de DNA e de uma capacidade, ainda que limitada, de síntese protéica, tem suscitado o aparecimento de várias hipóteses sobre a possível origem evolutiva das mitocôndrias. Uma das hipóteses mais interessantes é a de que tais organelas tenham sido, originalmente, procariontes de vida livre (equivalentes às bactérias aeróbicas) eventualmente fagocitados por organismos unicelulares fermentativos, semelhantes a bactérias ou que já possuíam alguma organização membranosa interna (um protoeucarioto).
Assim, existência de uma vantagem mútua neste tipo de associação (proteção e alimento para a bactéria, e uma fonte importante de energia para a célula hospedeira) teria levado, ao longo do tempo evolutivo, ao estabelecimento de uma relação simbiótica permanente entre os dois tipos de organismos. A fixação deste tipo de associação deve ter ocorrido com a transferência de praticamente todo o genoma da bactéria simbionte para o genoma da célula hospedeira, atualmente compartimentalizado no interior do núcleo celular. De fato, existem muitas semelhanças entre mitocôndrias e alguns tipos de bactérias que são geralmente apontadas como evidências que apóiam esta hipótese.
Por exemplo, a síntese protéica na bactéria e na mitocôndria são inibidas pelo antobiótico cloranfenicol, enquanto que a síntese protéica que ocorre no citoplasma celular não é inibida por essa substância. Muitos dos genes que estão no núcleo da célula, e que codificam proteínas mitocondriais, têm muitas semelhanças moleculares com genes bacterianos.
6. O peroxissomo
Os peroxissomos são organelas presentes em praticamente todas as células eucarióticas, e exibem uma identidade funcional muito peculiar que só atualmente tem sido explorada em detalhe pelos pesquisadores.
Particularmente evidentes em células de rim e fígado de mamíferos, assim como em vários tecidos vegetais, são organelas delimitadas por uma membrana única, sendo que, em alguns casos (como nas células do fígado), apresentam uma estrutura cristalina interna denominada de nucleóide (Fig. 4). Esta estrutura é formada por um acúmulo de uma determinada enzima peroxissômica (em geral, urato oxidase), que se cristaliza em seu interior.
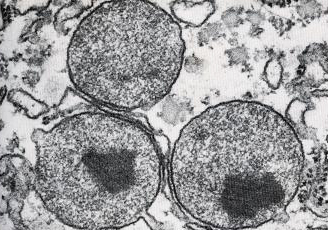
Figura 4: Micrografia eletrônica mostrando os peroxissomos. Note a ocorrência de um nucleóide em seu interior (cristais de urato oxidase), característico desta organela.
Fonte: FAWCETT, D.W. The cell. 2nd Ed. W. B. Saunders Company, Philadelphia. 1981.
Os peroxissomos são caracterizados pela presença de uma série de enzimas oxidativas, como a D-aminoácido oxidase, a urato oxidase e a catalase. Os peroxissomos devem seu nome ao peróxido de hidrogênio, um intermediário chave em seu metabolismo oxidativo. Este composto é produzido por uma série de oxidases que utilizam o oxigênio na remoção de átomos de hidrogênio de substratos específicos, tais como aminoácidos, purinas e alguns produtos do metabolismo de carboidratos, como o ácido lático.
O peróxido de hidrogênio produzido nessas reações é posteriormente utilizado pela catalase na oxidação de vários substratos, incluindo o ácido fórmico, formaldeído, etanol e metanol, com a simultânea redução do peróxido de hidrogênio a água.
No caso do etanol, os peroxissomos têm um papel desintoxicante, pois cerca de ¼ de todo etanol consumido pelo homem, por exemplo, é oxidado a acetaldeído principalmente no fígado. Na ausência destes últimos substratos citados, a catalase alternativamente converte moléculas de peróxido de hidrogênio em água (e oxigênio), o que constitui um dispositivo muito importante na prevenção de um acúmulo indesejável deste composto, altamente oxidante e prejudicial à célula (Fig. 5).
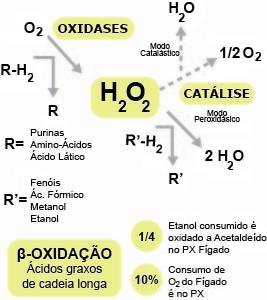
Figura 5: Metabolismo oxidativo do peroxissomo. A oxidação de aminoácidos, purinas e ácido lático, por atividade das oxidases, leva à formação de peróxido de hidrogênio (H2O2). Em seguida, a enzima catalase utiliza o H2O2 para a oxidação de diversos substratos, reduzindo-o a água. Esta redução do peróxido de hidrogênio pode ocorrer mesmo na ausência de um substrato disponível, evitando um eventual acúmulo deste composto altamente oxidante e prejudicial à célula. Como na mitocôndria, o peroxissomo ainda possui um papel importante na β-oxidação de ácidos graxos, embora restrito aos de cadeia longa.
Fonte: Original
A composição enzimática dos peroxissomos, assim como as funções que desempenham podem, ao contrário dos lisossomos, variar significativamente de um tipo celular para outro. Assim, em folhas verdes de muitas espécies vegetais, os peroxissomos participam de reações oxidativas de aproveitamento de subprodutos da fotossíntese, numa complexa interação com cloroplastos e mitocôndrias (Fig. 6). Como este processo é fotodependente e resulta no consumo de oxigênio e liberação de gás carbônico, é denominado fotorrespiração.
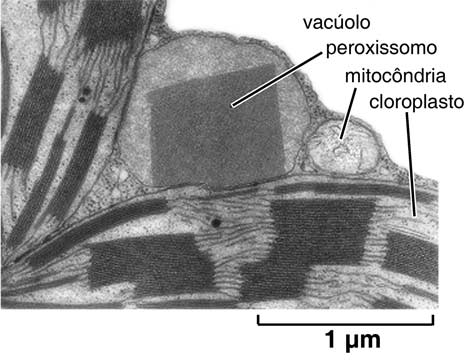
Figura 6: Micrografia eletrônica evidenciando um peroxissomo e sua íntima associação com uma mitocôndria e cloroplastos, facilitando as trocas de metabólitos para a realização da fotorrespiração.
Fonte: ALBERTS, B.; JOHNSON, A.; LEWIS, J.; RAFF, M.; ROBERTS, K. & WALTER, P. - Molecular Biology of the Cell. 5th Edition, New York, Garland, 2008.
7. O Glioxissomo – um peroxissomo com função específica
Alguns peroxissomos exercem funções mais específicas. Um tipo especial de peroxissomo, existente em sementes oleaginosas de certas espécies vegetais (como a mamona), é capaz de converter lipídios, forma principal de estocagem de energia nessas sementes, em carboidratos, que são utilizados durante a germinação. Como esta conversão é realizada através do chamado ciclo do glioxilato (uma variante do ciclo de Krebs), este tipo especial de peroxissomo é conhecido como glioxissomo (Fig. 7).
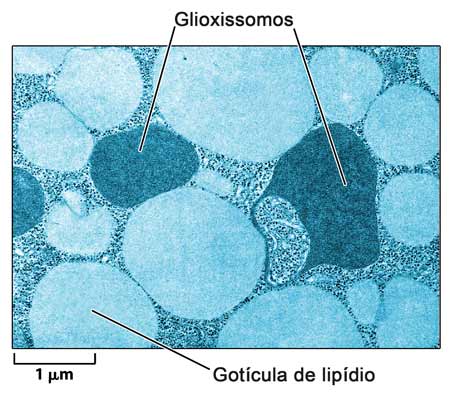
Figura 7: Micrografia eletrônica de um tipo especial de peroxissomo, o glioxissomo. Estas organelas ocorrem apenas em algumas sementes oleaginosas convertendo lipídios em carboidratos para fornecimento de energia durante a germinação.
Fonte: ALBERTS, B.; JOHNSON, A.; LEWIS, J.; RAFF, M.; ROBERTS, K. & WALTER, P. - Molecular Biology of the Cell. 5th Edition, New York, Garland, 2008.
8. O peroxissomo e o metabolismo celular oxidativo
Devido às suas atividades predominantemente oxidativas, os peroxissomos são considerados, juntamente com as mitocôndrias, como os principais sítios celulares de consumo de oxigênio. Para se ter uma idéia, 10% do consumo de oxigênio pelo fígado é devido ao metabolismo peroxissômico.
Neste particular, alguns pesquisadores acreditam que os peroxissomos representem os vestígios de antigas organelas presentes em células eucariontes primitivas, que teriam desempenhado todo o metabolismo celular oxidativo desde que o oxigênio se tornou disponível na atmosfera.
Contudo, com o surgimento das mitocôndrias, grande parte das reações oxidativas passaram a ser desempenhadas na nova organela com uma enorme vantagem: a energia liberada não era mais perdida em calor mas sim transformada, como vimos, numa fonte de energia facilmente utilizável pela célula — o ATP.
Seguindo ainda a mesma linha de raciocínio, os peroxissomos não teriam sido eliminados pela seleção natural, simplesmente porque muitas de suas reações ainda são importantes para a célula e são exclusivas desta organela. Assim, por exemplo, de forma semelhante às mitocôndrias, os peroxissomos também realizam β-oxidação de ácidos graxos, mas apenas os de cadeia longa, processo que a mitocôndria não é capaz de fazer. No caso das plantas e dos fungos, toda a β-oxidação só ocorre nos peroxissomos.
9. Como se originam os peroxissomos?
Atualmente acredita-se que os peroxissomos se originam a partir da divisão de peroxissomos pré-existentes (como no caso das mitocôndrias), mas com a participação de vesículas que brotam do retículo endoplasmático (vesículas pré-peroxissômicas) e que se fundem com essas organelas (Fig. 8). Com relação à origem das proteínas que compõem a organela, tudo indica que as de membrana venham diretamente do retículo endoplasmático (junto com as vesículas pré-peroxissômicas), enquanto que as proteínas enzimáticas da luz (matriz) do peroxissomo são sintetizadas no citossol e transportadas para dentro da organela. No caso da mitocôndria, a maior parte das proteínas são fabricadas, como vimos, no citossol e transportadas para as membranas ou compartimentos (externo e matriz).
Elas são desdobradas antes do transporte, passam pelos poros dos complexos protéicos das membranas e readquirem sua conformação tridimensional no local de destino. No caso das proteínas da matriz peroxissômica, paradoxalmente elas são transportadas sem desdobramento, como uma proteína globular e até oligomérica (formada por conjuntos de proteínas). Não se sabe como a membrana do peroxissomo executa esse transporte, pois não há evidências de poros ou de invaginações de membrana que expliquem este fenômeno. É possível que se formem poros protéicos dinâmicos que, após a passagem da proteína transportada, se desagreguem.
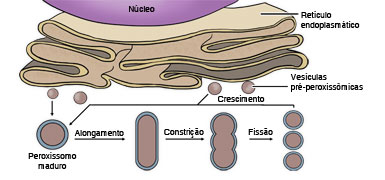
Figura 8: Modelo ilustrando a possível biogênese dos peroxissomos. Estas organelas se originam da fusão de vesículas oriundas do retículo endoplasmático (vesículas pré-peroxissômicas) e por divisão (fissão) de peroxissomos pré-existentes. As proteínas da luz do peroxissomo são produzidas no citossol e importadas através da membrana.
Fonte: Annual Rev Cell and Development Biology v.23, p 321, 2007.
10. Doenças associadas aos peroxissomos
Existem algumas doenças no homem devidas a disfunções dos peroxissomos. Uma das mais conhecidas é a síndrome de Zellweger. Nesta síndrome, aparentemente não se observam peroxissomos no rim ou no fígado (onde, normalmente, são mais evidentes) mas, curiosamente, as enzimas peroxissômicas são encontradas no citossol. Um exame mais detalhado das células indica a existência de peroxissomos, mas só que eles se encontram vazios. Assim esta síndrome é decorrente de mutações que levam a falhas nos sinais de importação das enzimas do citossol para o interior das organelas. As consequências são graves, sendo que os indivíduos portadores apresentam várias neuropatologias, disfunções hepática e renal e, geralmente, sobrevivem poucas semanas após o nascimento.
Enfim, como se pôde constatar, as mitocondrias e peroxissomos têm muito em comum como organelas oxidativas que são. Esta visão foi reforçada muito recentemente com a comprovação da existência de um transporte vesicular entre as duas organelas que media um intercâmbio de metabólitos, antes totalmente desconhecido.
11. Bibiografia
ALBERTS, B.; JOHNSON, A.; LEWIS, J.; RAFF, M.; ROBERTS, K. & WALTER, P. - Molecular Biology of the Cell. 5th Edition, New York, Garland, 2008.
Annual Rev Cell and Development Biology v.23, p 321, 2007.
DE ROBERTIS, E.D.P.; DE ROBERTIS, E.M.F. Jr. Cell and molecular biology. 2nd Ed. Saunders College, Philadelphia. 1980.
FAWCETT, D.W. The cell. 2nd Ed. W. B. Saunders Company, Philadelphia. 1981.
12. Mãos à obra
Atividade 1 – Teste seus conhecimentos. Responda as questões.